Krankheitsbild
Neuroendokrine Zellen sind das Bindeglied zwischen dem Nervensystem (neuro-) und dem Hormonsystem (endokrines System). Sie befinden sich in Hormondrüsen (z.B. Hirnanhangsdrüse, Nebenniere, C-Zellen der Schilddrüse etc.), in den Knotenpunkten der Nervenbahnen (Ganglien) sowie als diffuses neuroendokrines System in praktisch allen inneren Organen sowie in der Haut.
Sie können Hormone bilden, sie in kleinen Bläschen (Vesikeln) speichern und als Botenstoffe ins Blut abgeben. Diese Botenstoffe steuern vielfältige Vorgänge im Körper, wie z.B. die unterschiedlichen Stoffwechselschritte.
Neuroendokrine Tumore haben ihren Ursprung im diffusen Neuroendokrinen System und können somit in allen Organen auftreten. Besonders häufig sind sie im Dünndarm, in der Bauchspeicheldrüse sowie in den Bronchien/Lunge.
Pro Jahr erkranken 5-6/100 000 Einwohner, eher steigende Tendenz, wahrscheinlich auch aufgrund besserer Diagnostik.
Unter den Neuroendokrinen Tumorerkrankungen gibt es viele mit einer sehr niedrigen Zellteilungsrate, also auch einem sehr langsamen Wachstum, und einige wenige mit hoher Teilungsrate. Wenn dazu noch ein ungeordnetes chaotisches Zellmuster mit wenig Ähnlichkeit zum Ursprungsgewebe kommt (entdifferenziert), so nennt man diese Neuroendokrine Karzinome (NEC).
Die Abkürzung für Neuroendokrine Tumore ist NET, Mehrzahl (NET und NEC) wird mit NEN = Neuroendokrine Neoplasien bezeichnet.
Hier ein kurzes Video über NET:
Nachdem Sie das Video anklicken, werden externe Inhalte des Dienstleisters YouTube eingebunden und darin ggf. Cookies verwendet.
Im Bereich der Lunge heißen die NET immer noch Karzinoid (typisches und atypisches Karzinoid). Auch im Englischen wird der Begriff noch weitgehend verwendet.
Je nach ihrem Ursprungsorgan (z.B. Lunge, Bauchspeicheldrüse, Magen, Dünndarm, Dickdarm), ihrer Teilungsrate und Differenzierung verhalten sich NEN biologisch sehr unterschiedlich, auch abhängig davon ob sie Hormone ausschütten oder nicht und ob sie erblich bedingt oder zufällig entstanden (sporadisch) sind.
Im Laufe der letzten Jahre wurden verschiedene Klassifikationen der Krankheit NeT erarbeitet. Die Tumore werden eingeteilt nach:
- Größe
- Lymphknotenbefall
- Metastasierung =TNM
- Teilungsrate (Ki 67, MIB-1) mit G1 – G3
- Unterteilung der NEN G3 (Ki 67 > 20%) in gut differenzierte NET G3 und schlecht differenzierte NEC G3 (nach der WHO-Klassifikation von 2019)
Eine ständige Überarbeitung und Fortentwicklung findet statt, mit dem Ziel, dass auf der ganzen Welt eine bestimmte Neuroendokrine Neubildung auch stets gleich benannt wird, damit z. B. Studien auch international vergleichbar sind.
Nach dem Entstehungs- oder Ursprungsort der NEN spricht man von:
- GI-NEN bei Entstehung im Gastrointestinaltrakt, d. h. Speiseröhre, Magen, Zwölffingerdarm, Dünndarm (am häufigsten) und Dickdarm/Mastdarm
- P-NEN bedeutet pankreatische NEN, mit Ursprung in der Bauchspeicheldrüse
- GEP-NEN beinhalten beide, also NEN der Bauchspeicheldrüse und des Magen-Darm-Trakts. Hierzu gehören ca. 70% der NEN.
- Ca. 25 % der NEN entstammen Lunge oder Thymusdrüse-NEN
- 5% entstehen in anderen Organen: sehr seltene NEN vom neuronalen Typ Phäochromozytom, Paragangliom.
Zum anderen werden NET danach eingeteilt, ob sie Hormone freisetzen und dadurch bestimmte Symptome hervorrufen. Bei solchen Hormonsyndromen spricht man von funktionell aktiven Tumoren (ca. 25 % der NET).
Ca. 75 % der NET sind Geschwülste, die zwar Hormone enthalten, aber sie nicht abgeben bzw. werden die Hormone abgebaut, bevor sie Symptome machen können. Diese werden als hormon inaktiv oder funktionell inaktiv beschrieben.
Zudem können NEN selten im Rahmen von erblichen Krankheiten wie z.B. MEN 1 und 2 (Multiple neuroendokrine Neoplasien) auftreten.
Funktionell aktive NET bilden Hormone. Besonders häufig sind dies:
- Serotonin (70% – 80% der Dünndarm-NET, auch in Karzinoiden der Lunge)
- Insulin
- Gastrin
- sehr selten Glukagon, Somatostatin oder VIP (vasoaktives intestinales Peptid)
- sowie weitere seltene Hormone
Die Endsilbe „-om“ bei einem Neuroendokrinen Tumor sagt aus, welches Hormon gebildet wird, z.B. produziert ein Insulinom Insulin, ein Glukagonom Glukagon usw. Einzelheiten dazu lesen Sie hier.
Hormonell inaktive NEN rufen oft gar keine Symptome hervor, werden zum Teil zufällig bei einer Routineuntersuchung z. B. mit Ultraschall entdeckt. Oder sie machen sich am Ort ihres Wachstums bemerkbar: Bauchschmerzen bis hin zum Darmverschluss bei Einengung des Dünn-oder Dickdarms, Gelbsucht bei Verlegung der Gallenwege, Lungenentzündung bei Verschluss eines Bronchus in der Lunge, etc.
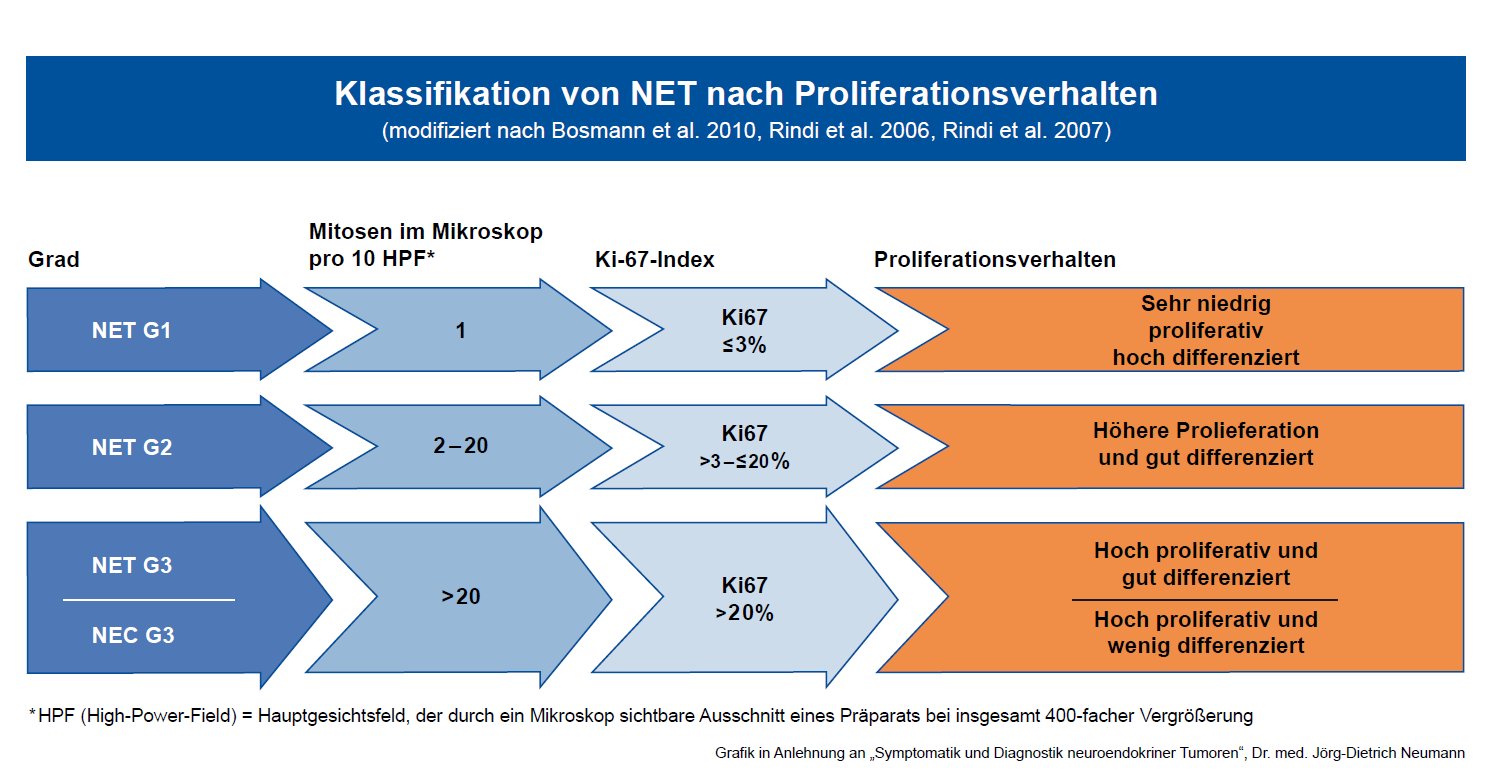
Ein weiteres wichtiges Unterscheidungsmerkmal ist das Proliferationsverhalten: hiermit wird beschrieben, wie häufig sich die Zellen in einem Tumor teilen.
Bei den Neuroendokrinen Tumoren bestimmt der Pathologe in einer Gewebeprobe mit einer bestimmten Färbemethode, wie viele Zellen sich gerade (in einem bestimmten Gesichtsfeld unter dem Mikroskop) in Teilung befinden.
Dieser Index wird mit Ki 67 bzw. MIB-1 bezeichnet.
Ein niedriges Ki67 zeigt an, dass die Zellteilung gering und damit die Tumorwachstumsgeschwindigkeit langsam ist.
Außerdem beurteilt der Pathologe die Art des Gewebeaufbaus. Ist dieser noch gut geordnet und ähnelt dem Ursprungsgewebe, nennt man dies gut differenziert. Ist er hingegen chaotisch und weit entfernt von der Architektur des Ursprungsgewebes spricht man von entdifferenziert.
In folgendes Gradsystem werden die NET eingeteilt:
- Grad 1 (G1): Ki 67 unter 3% (sehr niedrige Wachstumsrate)
- G2: Ki 67 ab 3% bis 20%( mittlere Wachstumsrate)
- G3: Ki 67 >20%, unterteilt in gut differenzierte NET G3 und
- schlecht differenzierte NEC G3
Dieses Grading hat die höchste Voraussagekraft für das Verhalten des Tumors und bestimmt auch weitgehend, welche Therapiemethoden bei NET angewandt werden.
Die Ausdehnung der Krankheit NeT wird hier beschrieben: Tumorformel im TNM-System.
- T = Tumorgröße und Ausdehnung
- T1 (kleiner Tumor) bis T4 (großer Tumor, der die Organgrenzen überschritten hat)
- N (Nodulus/ Lymphknoten) = Befallene, dem Ursprungstumor naheliegende Lymphknoten.
- N0: alle Lymphknoten tumorfrei
- N1: einige befallen
- N2, N3: noch mehr Lymphknoten befallen
Beispiel: N1 (3/35) bedeutet, dass 35 Lymphknoten entnommen wurden, 32 Lymphknoten waren gesund, 3 enthielten Tumorzellen.
- M = Metastase oder Fernabsiedlung/Tochtergeschwulst.
- M0 heißt: alle anderen Organe sind tumorfrei,
- M1 = man hat Metastasen gefunden und gibt in Klammern an, wo. z. B. (hep) bedeutet Leberbefall.
- Mx heißt: man weiß es nicht. Der Pathologe hat ja nur eine gewisse Gewebemenge zur Untersuchung erhalten und kann nichts über den Rest des Körpers aussagen
- R bedeutet Resektion, Entfernung.
- R0 = alles im Gesunden mit ausreichend Sicherheitsabstand entfernt
- R1 = an einem Rand sind mikroskopisch kleine Tumorreste verblieben, kein ausreichender Abstand zum gesunden Gewebe
- R2 = schon der Chirurg konnte erkennen, dass Tumorreste verblieben sind.
- Ein p vor der Tumorformel bedeutet pathologischer Befund.
- Ein c bedeutet Klinischer Befund durch andere Untersuchungsmethoden (CT, MRT, Sonographie etc).
Durch das Grading und das TNM-System können NEN auf der ganzen Welt einheitlich beschrieben werden. Die Ärzte können sich im Tumorboard/Tumorkonferenz schnell verständigen und das beste weitere Vorgehen anhand der Formeln beratschlagen und festlegen.
Neuroendokriner Tumor (NET) ist eine Bezeichnung, die als Oberbegriff für eine Gruppe von Tumoren mit Ursprung in neuroendokrinen Zellen verwendet wurde.
Die neueste Terminologie ist Neuroendokrine Neoplasien oder NEN: „Neoplasma“ bedeutet neues (abnormales) Wachstum.
Zu den neuroendokrinen Neoplasien gehören alle neuen und abnormen Wucherungen, die in neuroendokrinen Zellen beginnen, unabhängig davon, ob sie gutartig (nicht krebsartig) oder bösartig (krebsartig) sind.
Bösartige neuroendokrine Zellen sehen anomal aus. Der Grad der Anomalie wird mit dem Wort Differenzierung beschrieben.
Hier finden Sie eine Komplettübersicht zum NET als Primärtumor: Was sind primäre NET?
Informationen zum sekundären neuroendokrinen Tumor (metastasierende Erkrankung)? Was ist ein metastasierter NET?
Was sind hochgradige neuroendokrine Tumore? Was sind hochgradige NET?
Quelle: INCA (www.incalliance.org)
NET können in allen Organen auftreten, in denen neuroendokrine Zellen vorkommen.
NET können unterschiedliche Symptome hervorrufen. Erfahren Sie mehr über die Leitsymptome verschiedener neuroendokriner Syndrome.
Zur Diagnose von NET kommen unterschiedliche Methoden zum Einsatz, die der Therapiefindung und Verlaufskontrolle dienen.
In manchen Fällen lassen sich NET nur durch eine mikroskopische Untersuchung des Gewebes diagnostizieren.
Je nach Lokalisation, freigesetzter Hormone und Wachstum der NET, bedarf es individueller Behandlungsansätze.
2018 wurde die wurde die S2k-Leitlinie Neuroendokrine Tumoren (Stand 2018) veröffentlicht.
Zur Überprüfung neuer Therapieansätze und Medikamente sind klinische Studien notwendig.
Wir haben für Sie nützliche Links zu Webseiten und hilfreichen Infoquellen zum Thema NET zusammengestellt.
Erfahren Sie mehr über die Krankheit NET, die Arbeit unserer Selbsthilfeorganisation und unsere Aktivitäten.